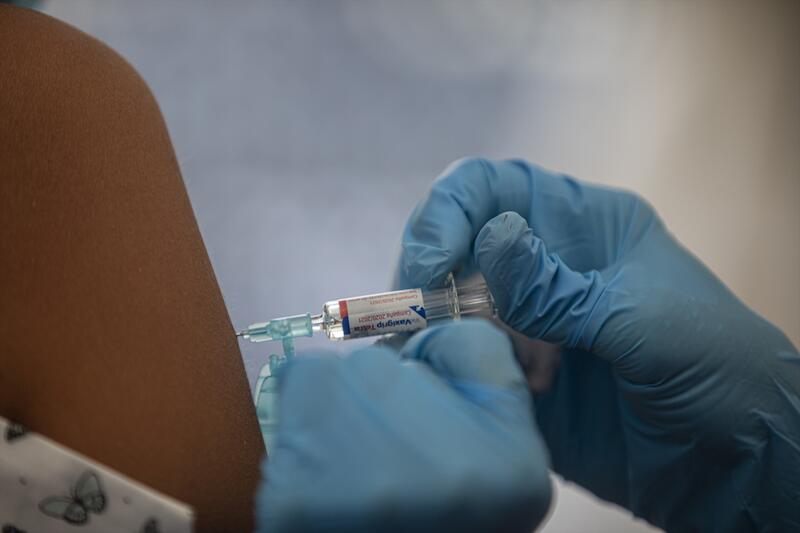
La jefe del servicio de medicina preventiva y epidemiología del Hospital Vall d’Hebron de Barcelona, Magda Campins, ha explicado que el centro ha empezado el reclutamiento de voluntarios para participar en el ensayo clínico en fase 3 de la vacuna contra el Covid-19 de la farmacéutica Janssen.
En rueda de prensa este miércoles junto a las otras responsables del ensayo en el centro catalán Susana Otero e Ingrid Carbonés, Campins ha concretado que se trata del «primer ensayo de estas características» que se ha autorizado en el Estado.
Este miércoles han empezado el reclutamiento –que han estimado que finalizará en tres meses aproximadamente– y Campins ha precisado que la previsión del centro es empezar a vacunar la primera semana de enero a medida que vayan reclutando, también, más voluntarios.
La Agencia Española de Medicamentos y Productos Sanitarios (Aemps) autorizó el noviembre pasado el ensayo para evaluar «la eficacia y la seguridad» de la vacuna tanto en voluntarios sanos como en participantes con enfermedades que se asocian a un mayor riesgo de progresión a Covid-19 grave.
Este ensayo incluirá hasta 30.000 voluntarios de nueve países distintos –Bélgica, Colombia, Francia, Alemania, Sudáfrica, Filipinas, España, Reino Unido y Estados Unidos– y en el que además del centro catalán, que espera aportar 200 voluntarios, participan otros siete hospitales del Estado.
En concreto, estos centros son: el Hospital Clínic de Barcelona, el Hospital Quirónsalud de Barcelona, el Hospital Germans Trias i Pujol de Badalona (Barcelona), el Hospital de la Princesa de Madrid, el Hospital la Paz de Madrid, el Hospital Quirónsalud de Madrid y la Clínica Universidad de Navarra.
PERFIL DE LOS VOLUNTARIOS
Sobre el perfil de los voluntarios, las doctoras han precisado que no podrán participar en el ensayo personas inmunodeprimidas por una enfermedad de base o bien en tratamiento con medicamentos inmunosupresores.
Tampoco se permite la participación de mujeres embarazadas o con probabilidad de embarazo en los dos próximos años, personas con antecedentes de anafilaxia o reacciones adversas graves a las vacunas ni personas que ya participen en otros ensayos clínicos.
Al coincidir con el despliegue de la campaña de vacunación, Campins ha lamentado que habrá personas que se habían presentado voluntarias que saldrán del ensayo porque no pueden participar si les administran la vacuna.
El grupo en el que hay «más personas que saldrán» del ensayo será el de los profesionales sanitarios porque son un colectivo prioritario dentro de la estrategia de vacunación y, según Campins, decidirán lógicamente no participar.
ENSAYO
La vacuna, llamada Ad26.COV2.S, no contiene el virus vivo sino que utiliza una proteína artificial del virus para que el organismo genere anticuerpos.
El estudio es randomizado, doble ciego y controlado con placebo, es decir, de manera aleatoria se les administrará a la mitad de los participantes la dosis mientras que la otra mitad recibirá el placebo.
Además, el placebo será enmascarado por lo que ni el personal sanitario ni los voluntarios podrán identificar qué producto se está administrando.
Este ensayo estudiará «la seguridad y la eficacia» en un régimen de dos dosis de la vacuna que se inyectarán con 57 días de diferencia entre la primera y la segunda dosis, y se hará un seguimiento de los voluntarios durante dos años.
SEGUIR DESARROLLANDO VACUNAS
Campins ha defendido que es «imprescindible» seguir desarrollando otras vacunas candidatas para poder garantizar una mayor disponibilidad y también poder perfilar estrategias ajustadas a cada grupo poblacional según el tipo de vacuna.
Ha concretado que puede ser que haya vacunas que tengan una «mayor efectividad» en personas de edad avanzada y otras más efectivas en gente con patologías de base, entre otros.